2022年8月8日,中国科学院上海药物研究所徐华强研究员联合临港实验室蒋轶研究员、北京协和医院张抒扬教授,共同在国际著名学术期刊《自然》杂志上发表最新研究成果,首次解析了全长TSHR分别处于激素TSH与人源激活型抗体M22结合的激活状态结构以及人源抑制型抗体K1-70结合下的抑制态结构。
该项工作首次揭示了TSH与TSHR相互作用的细节模式,阐明了决定TSH和TSHR特异性识别的关键氨基酸残基,并揭示了TSH激活TSHR的分子机制,揭示了抗体激活或抑制受体从而引发GD和Hashimoto’s disease的分子机制,并进一步揭示了小分子别构激动剂ML-109与受体TSHR相互作用细节模式,为临床开发用于治疗甲状腺相关疾病的抗体或小分子药物提供了结构依据。
近年来,甲状腺相关疾病的发病率正逐年上升,我国甲状腺相关疾病的总患病率高达20%。甲状腺相关疾病主要包括甲状腺功能亢进(甲亢)、甲状腺功能减退(甲减)、甲状腺结节,以及甲状腺癌。
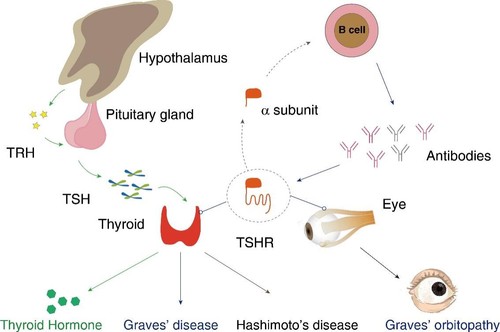
甲状腺的主要生理功能是分泌甲状腺素调控机体能量代谢,而这一功能的实现依赖于甲状腺细胞表面的促甲状腺素受体(TSHR)感知垂体细胞分泌的促甲状腺激素(TSH)信号。
临床研究发现,弥漫性毒性甲状腺肿(又称Graves’disease,GD)是甲状腺功能亢进的主要疾病表型,其发病机理是机体免疫系统产生了能够特异性识别TSHR的激活型抗体,甲状腺细胞表面的TSHR受到抗体持续激活进而引起甲状腺分泌过多的甲状腺素引发疾病。
与此同时,激活型抗体也会激活表达在眼眶成纤维细胞膜上的TSHR,从而导致眼睛肌肉肿胀,引发格氏眼病,患有GD的患者近半数也会同时患上格氏眼病。
此外,临床也存在部分甲减患者,其疾病类型为自身免疫性桥本病(又称Hashimoto’s disease),其患者中,一部分是由于免疫系统产生了靶向TSHR的抑制性抗体所致。
因此,TSHR在介导甲状腺发挥正常的生理功能外,也参与了甲状腺相关疾病的发生发展。
TSHR在体内介导的生理及病理过程
TSH属于糖蛋白激素的一员,与绒毛膜促性腺激素CG、促黄体生成素LH,以及促卵泡激素FSH共同构成糖蛋白激素家族。在人体内,这四种糖蛋白激素可作用于三种糖蛋白激素受体,其中TSH可以作用于TSHR。
TSH作为糖蛋白激素的重要一员,由于其结构的复杂性及不稳定性,目前仍无任何TSH的结构信息被报道。但同时,TSH又是用于辅助治疗甲状腺癌的重要临床药物,也是包括McCune-Albright综合征、垂体促甲状腺激素腺瘤以及原发性先天性甲状腺功能减退症在内的多种重大罕见病的重要靶标和关键分子。
可惜的是,围绕TSH与TSHR的各种谜团,一直困扰着科学家和医生,靶向TSHR的小分子别构激动剂是如何激活受体的分子机制也一直是研究的重点。
此次,这个长期致力于糖蛋白激素受体家族的结构与功能研究的研究团队,再次在糖蛋白激素研究领域取得了突破性进展。
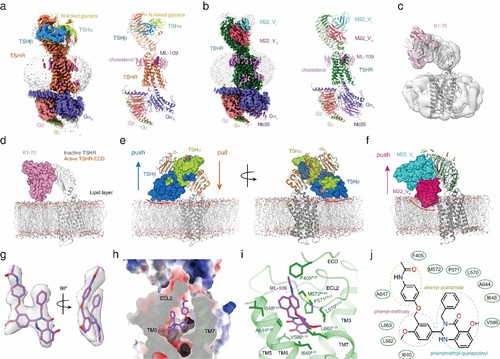
研究人员采用单颗粒冷冻电镜技术,分别对TSH激活TSHR形成的Gs复合物、人源激活型抗体M22激活TSHR形成的Gs复合物以及人源抑制型抗体结合的TSHR进行了结构重塑,其多个分子机构的分辨率达到了小于3埃的“超高清”水准。
其中,TSH-TSHR-Gs复合物结构的整体分辨率为2.96埃,胞外局部分辨率为2.67埃,M22-TSHR-Gs复合物结构的整体分辨率为2.78埃,胞外局部分辨率为2.39埃,K1-70-TSHR复合物的分辨率为5.46埃。
通过结构分析,研究人员首次确定了激素TSH与TSHR特异性识别的关键氨基酸残基,再次证实了TSH激活TSHR仍遵循“push and pull”激活模型,即糖蛋白激素激活受体均遵循“push and pull”这一保守的激活机制。与此同时,研究人员还从结构比较发现,抗体激活受体只存在“push”这一种作用方式。
最后,研究人员也分析了小分子激动剂ML-109与受体TSHR相互作用的分子细节,并通过进一步的突变实验确定了决定ML-109特异性识别并激活TSHR而不激活LHCGR的关键氨基酸残基。
TSH、M22以及K1-70与TSHR和Gs蛋白的复合物结构比较
本研究系统性地研究了TSHR与内源性激素TSH和小分子激动剂ML-109的结构,首次揭示了激素TSH和别构激动剂ML-109诱导受体激活的机制;通过解析激活型抗体M22和抑制型抗体K1-70与TSHR的结构,揭示了TSHR如何被自身免疫性抗体激活或抑制的结构基础,从而为针对TSHR功能异常从而引发的自身免疫性疾病的抗体药物和小分子药物发现提供了更加清晰地模板和思路。