赖氨酸琥珀酰化修饰(Lysine succinylation,Ksu)是以琥珀酰辅酶A为底物受酶或非酶催化形成的赖氨酸酰化修饰家族的重要成员之一,广泛存在于各个物种间,主要分布在细胞线粒体、细胞核和细胞质中。目前,已报道KAT2A和HAT1作为琥珀酰化转移酶,分别催化H3K79su和H3K122su,而CBP/p300也被报道参与催化组蛋白琥珀酰化,并且组蛋白琥珀酰化修饰可以促进转录表达、肿瘤细胞增殖和发展等。同时,SIRT5是目前已报道主要的去琥珀酰化酶。SIRT5是Sirtuin家族NDA+依赖的去酰化酶,主要存在于线粒体中,SIRT5缺失会导致线粒体蛋白高度琥珀酰化,参与调控脂肪酸代谢和TCA循环等生物过程。最近发现SIRT7可以去除H3K277su,但是主要的组蛋白去琥珀酰化酶是否是Sirtuin家族尚不清楚。
为解决上述问题,华东师范大学翁杰敏教授、魏伟副研究员与中国科学院上海药物研究所黄河研究员于2023年8月15日在Cell Discovery杂志在线发表了题为“HDAC1/2/3 are major histone desuccinylase critical for promoter desuccinylation”的研究论文,首次揭示I类HDACs(HDAC1/2/3)而非Sirtuin家族是主要的组蛋白去琥珀酰化酶,参与调控基因启动子区域的组蛋白琥珀酰化修饰从而影响转录调控。
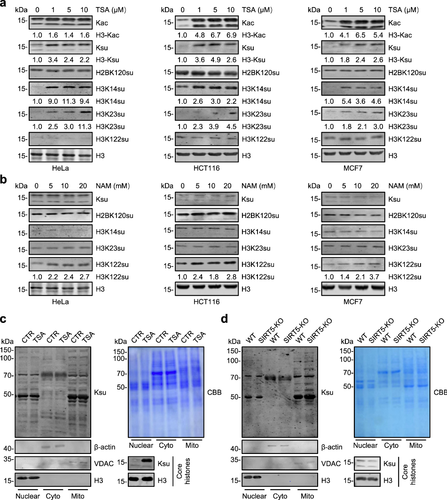
为了探究主要的组蛋白去琥珀酰化酶是SIRTs还是HDACs,研究人员在不同细胞系中使用广谱HDACs抑制剂TSA和广谱SIRTs抑制剂NAM处理,发现TSA处理可以显著增强不同细胞系中整体组蛋白琥珀酰化修饰水平,而NAM处理对整体组蛋白琥珀酰化修饰影响不大,仅增强H3K122su修饰水平,与之前报道SIRT7负责去除H3K122su相符。上述结果表明,HDACs负责调控更广泛的组蛋白琥珀酰化位点,而SIRTs可能只负责调控某个特定的组蛋白琥珀酰化位点,如H3K122su。此外,通过分离细胞核、细胞质和线粒体蛋白发现,HDACs去琥珀酰化底物蛋白主要是组蛋白,而SIRTs尤其是SIRT5可能主要负责线粒体蛋白的去琥珀酰化。
图1.HDACs是广泛的组蛋白去琥珀酰化酶
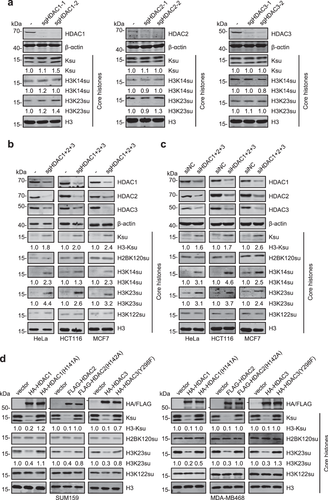
由于MS275(HDAC1/2/3选择性抑制剂)和TSA处理后组蛋白琥珀酰化增强效果相近,研究人员猜想HDAC1/2/3是HDACs中主要的组蛋白去琥珀酰化酶。通过单独敲除HDAC1、HDAC2或HDAC3发现,组蛋白琥珀酰化修饰未见显著升高,说明HDAC1/2/3可能存在代偿作用。然而,共敲除HDAC1/2/3可以显著增强组蛋白琥珀酰化修饰,包括H3K14su和H3K23su。过表达HDAC1/2/3而非其酶失活突变体显著降低组蛋白琥珀酰化修饰,包括H3K23su。此外,通过体内纯化HDAC1/2/3进行体外酶活实验发现,HDAC1/2/3展现显著的组蛋白去琥珀酰化能力,而酶失活突变体HDAC1/2/3不能。上述结果表明HDAC1/2/3是哺乳动物细胞中主要的组蛋白去琥珀酰化酶。
图2.HDAC1/2/3是组蛋白去琥珀酰化酶
最后,研究人员通过对是否经过TSA处理的细胞采用Pan-Ksu和H3K23su抗体进行ChIP-seq来获取整体的组蛋白琥珀酰化基因组分布情况。研究发现,TSA处理可以显著增强基因启动子区域的琥珀酰化水平。同时,结合转录组分析发现TSA处理后转录上调的基因,其启动子区域组蛋白琥珀酰化经TSA处理后也增强,说明HDAC1/2/3可以通过调控基因启动子区域组蛋白琥珀酰化水平参与转录调控,并且组蛋白琥珀酰化水平与转录激活正相关。
综上,该研究首次揭示HDAC1/2/3而非SIRTs是主要的组蛋白去琥珀酰化酶,并首次在体外验证了HDAC1/2/3强大的组蛋白去琥珀酰化能力。除此之外,该研究还发现HDAC1/2/3通过影响基因启动子区域的琥珀酰化水平调控基因转录,为组蛋白琥珀酰化的生理功能和病理研究提供了新思路。
华东师范大学翁杰敏教授、魏伟副研究员和上海药物所黄河研究员为本文的共同通讯作者。华东师范大学附属芜湖医院博士后李佳伦、华东师范大学生命科学院博士研究生卢璐和中国科学院上海营养与健康研究所博士研究生刘玲玲为该论文的共同第一作者。本研究得到国家自然科学基金委、上海市科技委员会资助。