8月10日,国际学术期刊Nature Metabolism杂志在线发表了中国科学院上海营养与健康研究所王莹研究组和时玉舫研究员题为“Glycolytic neutrophils accrued in the spleen compromise anti-tumour T cell immunity in breast cancer”的研究成果,揭示了乳腺癌进展中脾脏嗜中性粒细胞竞争性消耗葡萄糖,借以PKM2影响STAT5磷酸化,从而抑制T细胞抗肿瘤免疫应答的新机制。
肿瘤免疫微环境特征与功能的解析,极大地丰富了人们对肿瘤发生与发展的理解,并开启了肿瘤免疫治疗的新纪元。大量研究表明,肿瘤病灶中紊乱的代谢微环境,是干扰抗肿瘤免疫应答的巨大障碍。然而,抗肿瘤免疫应答的启动和维持受多重因素的影响,不仅涉及肿瘤病灶内肿瘤细胞与微环境,也与病灶外的免疫组织和器官的免疫状态密切相关。因此,肿瘤组织微环境中T细胞耗竭、反应性下降机制的理解是提升抗肿瘤免疫治疗有效性的关键。
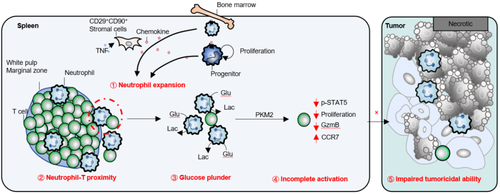
依靠正电子发射计算机断层显像(PET-CT)技术,研究人员发现浸润性乳腺癌患者和乳腺癌小鼠的脾脏葡萄糖代谢与肿瘤负荷之间存在显著的正相关关系。利用乳腺癌小鼠模型,研究人员发现嗜中性粒细胞的显著聚集是引起脾脏代谢改变的主要细胞类群。更重要的是,通常只有淋巴细胞驻留的脾脏白髓,也出现了大量的嗜中性粒细胞浸润,以及广泛的嗜中性粒细胞与淋巴细胞相互作用。结合代谢组学、免疫学研究等手段,研究人员发现白髓中的中性粒细胞通过与T细胞竞争葡萄糖,借以代谢途径引起T细胞的无能状态,限制其抗肿瘤能力。这一过程发生在T细胞到达肿瘤部位之前。脾脏嗜中性粒细胞对环境中葡萄糖的剥夺借以影响T细胞的丙酮酸激酶2(pyruvate kinase M2,PKM2),调控PKM2与STAT5的相互作用,显著抑制STAT5信号通路,而该信号通路对于T细胞增殖和功能分子的表达至关重要。同时,在不激活能量感受器AMPK的情况下,抑制PKM2即可降低STAT5的磷酸化水平。由此,研究人员提出嗜中性粒细胞以葡萄糖剥夺的方式,通过PKM2抑制STAT5信号通路从而干扰T细胞应答的分子机制。此外,利用核苷类似物的示踪实验,研究人员证实脾脏嗜中性粒细胞的来源至少存在脾内造血和骨髓招募两种途径。其中,脾脏嗜中性粒细胞的驻留,受到肿瘤诱导趋化因子CCL9与嗜中性粒细胞表达的CCR1的调控。阻断CCR1可以降低嗜中性粒细胞在脾脏的比例和数目,且抑制肿瘤的生长。作为CCL9的主要来源,脾脏间充质基质细胞在招募和促进脾内嗜中性粒细胞驻留中扮演重要角色。该研究揭示了嗜中性粒细胞调控脾脏代谢微环境,抑制T细胞抗肿瘤免疫应答的新机制,为理解嗜中性粒细胞与T细胞的相互作用远程调控乳腺癌发生与发展提供了崭新视角。
中国科学院上海营养与健康研究所博士王瑜、博士研究生徐慕晗为该论文的共同第一作者。中国科学院上海营养与健康研究所王莹研究员、时玉舫研究员为论文的共同通讯作者。该工作得到了上海全景云医学影像诊断中心石华铮教授,以及复旦大学红房子医院孙建教授的合作支持。该工作得到了科技部国家重点研发计划项目、国家自然科学基金委的资助,以及中国科学院上海营养与健康研究所所级公共技术平台和动物平台的支持。
图注:乳腺癌病理进程中,脾脏嗜中性粒细胞的聚集通过剥夺葡萄糖,借以PKM2-STAT5通路削弱T细胞抗肿瘤免疫应答。
文章链接:https://doi.org/10.1038/s42255-023-00853-4